Em Química, uma solução é definida como a mistura homogênea de duas ou mais substâncias: a que dissolve, chamada de soluto ou disperso, e a que solve, o solvente ou dispersante. Soluções líquidas são as mais apresentadas, porém também há soluções gasosas e sólidas. No caso das sólidas, é preciso torná-las líquidas para realizar a mistura. Soluções estão muito presentes em nosso cotidiano, como em um suco, uma liga de aço, grande parte das reações químicas e em um composto de água e sal, que será o exemplo mais utilizado.
O soluto sempre será a substância em menor quantidade, em oposição ao solvente. A água é usada como solvente universal, mas por ser polar, apenas dissolve outras substâncias polares. Para dissolver uma molécula polar, como a da naftalina, é preciso de um solvente também polar, como o hexano. Ao misturar sal (soluto) na água, a solução estará em uma das três categorias possíveis conforme a concentração:
● Insaturada, quando há baixa concentração de soluto;
● Saturada, quando a concentração atinge o coeficiente de solubilidade;
● Supersaturada, quando ultrapassa o coeficiente de solubilidade,
precipitando o soluto em excesso.
A concentração é determinada pela quantidade de soluto no solvente, e pode ser expressa em diversas formas. A mais utilizada cotidianamente é a comum, uma simples divisão de gramas de soluto por litro da solução. O título ou fração em massa considera apenas as massas, sendo a divisão da massa do soluto pela massa do solvente. O título em volume é semelhante, mas leva no cálculo o volume no lugar das massas, e ambos os títulos não possuem unidade, pois são geralmente expressos em percentual. Em laboratórios, é mais usada a concentração molar, que é expressa em mols (quantidade de matéria) do soluto por litro de solvente.
Coeficiente de solubilidade, por sua vez, é a concentração máxima de soluto que o solvente em questão é capaz de dissolver, normalmente expressa em gramas de soluto por gramas de solvente. Vale ressaltar que ele pode variar conforme as condições de temperatura e pressão. A solubilidade do NaCl na água a condições normais de temperatura e pressão equivale a 36 gramas para cada 100 gramas de água, ou seja, se misturar mais que 36 gramas de sal num copo de 100 gramas de água, parte dele não diluirá e formará um corpo de fundo.
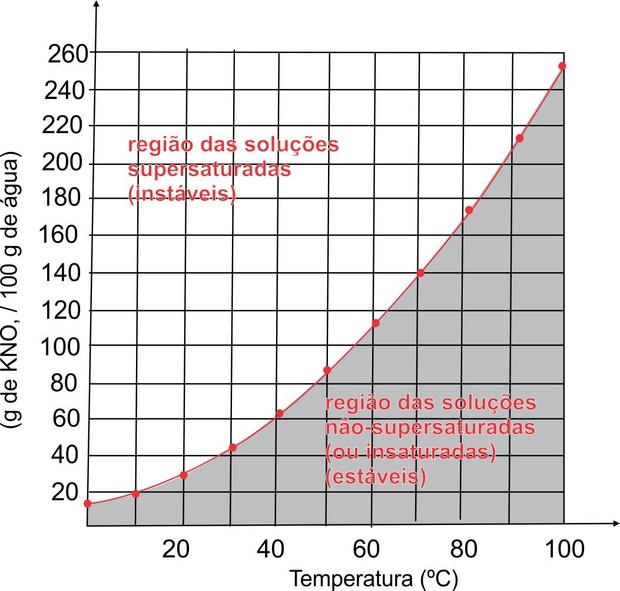
Sabendo que a solubilidade varia em função da temperatura, podemos registrá-la na forma de gráfico, chamado de curva de solubilidade. O exemplo a seguir mostra o coeficiente de solubilidade do nitrato de potássio (KNO 3 ) em 100 gramas de água.
Com isso, podemos concluir que a maioria dos compostos ao nosso redor são soluções, apesar de terem categorias muito mais distintas e que podem ser mais aprofundadas do que esta pesquisa apresenta. Elas estão por aí naturalmente, como a água que se encontra em rios e mares, nos minérios dos quais são retirados componentes químicos, podem também serem criados pela indústria como combustíveis e ligas metálicas, ou por nós mesmos, ao misturar o sabão em pó em água para lavar roupa e entre outros. A Química busca estudar e dá nome a cada coisa que é possível nesses casos, para que possamos prever algo mesmo quando não se pode realizar.
Referências
http://manualdaquimica.uol.com.br/fisicoquimica/coeficientesolubilidade.htm
Google Imagens.
http://educacao.uol.com.br/disciplinas/quimica/solucoessolutosolventeconcentracaoecurvadesolubilidade.htm
http://www.infoescola.com/compostosquimicos/solventes/
Meu caderno.
Nenhum comentário:
Postar um comentário